Candidemia e candidíase invasiva são infecções fúngicas causadas por espécies de Candida spp. e estão associadas a uma mortalidade atribuível de aproximadamente 30%. Com sinais e sintomas inespecíficos, o diagnóstico e tratamento podem ser difíceis e mesmo desafiadores.1
Importância clínica de infecções por Candida spp.
A epidemiologia dessas condições varia de acordo com a área geográfica e com a população específica estudada, mas fatores de risco frequentemente encontrados incluem internação em unidades de terapia intensiva, uso de cateter venoso central, uso de antibióticos de largo espectro, cirurgia abdominal e imunossupressão.1
Embora C. albicans seja historicamente a espécie mais comum, outras espécies – coletivamente denominadas como Candida não albicans – vêm ganhando importância como agentes etiológicos.1 Entre essas espécies, C. glabrata se destaca, tanto pelo aumento em sua prevalência quanto pela predisposição a apresentar resistência aos antifúngicos mais utilizados.2
Pilares do manejo e o papel das equinocandinas
Tratamento antifúngico precoce e controle de foco são considerados os pilares para redução de mortalidade.1 Em relação ao primeiro, os guidelines e diretrizes internacionais recomendam a administração das equinocandinas como primeira linha de tratamento de candidemia e de candidíase invasiva.3 Esses antimicrobianos possuem como alvo a enzima 1,3-β-D-glucana sintase, presente somente nas células fúngicas.3 Enquanto classe, possuem espectro de ação semelhante, embora diferentemente de outros antifúngicos, como os azólicos, estão sujeitas a poucas interações medicamentosas.4
Caspofungina, anidulafungina e micafungina foram as primeiras equinocandinas disponíveis. Mais recentemente, a rezafungina, foi desenvolvida e liberada para uso clínico.4,5 Essa última apresenta algumas propriedades que a diferencia dos demais componentes da classe, tanto em termos de farmacocinética, quanto em sua ação sobre espécies e cepas de Candida spp. com diferentes perfis de suscetibilidade.
Rezafungina: o que a diferencia das demais?
A rezafungina apresenta meia-vida prolongada, que, em estudos de fase 1, foi de aproximadamente 133 horas, o equivalente a 5,5 dias, em humanos.2 Dessa forma, pode ser administrada em dose semanal, diferente das outras equinocandinas, que necessitam de administração diária.2,4 Além disso, modelos de farmacocinética/farmacodinâmica (PK/PD) indicaram uma taxa de clearance da droga significativamente menor do que a estimada para as outras equinocandinas, o que sugere que valores mais altos da área sob a curva de concentração (AUC) podem ser alcançados com a mesma dose. Esse parâmetro é importante uma vez que a razão da AUC sobre a concentração inibitória mínima (MIC), ou AUC, é o parâmetro mais bem relacionado à eficácia dessas drogas.2
Outra diferença importante em relação às primeiras equinocandinas refere-se à estabilidade. Tanto a caspofungina quanto a anidulafungina e a micafungina apresentam degradação térmica e hidrolítica. Além disso, a micafungina também está sujeita à fotodegradação.6 Essas características levam a algumas dificuldades, como a limitação na produção de doses diferentes e no tempo de estabilidade das preparações intravenosas, que são de 24 a 48 horas no máximo.6 Já a rezafungina apresenta estabilidade no plasma, em solução aquosa e em altas temperaturas, facilitando produção e armazenamento.6
Atividade antifúngica
A ação da rezafungina sobre diferentes espécies e cepas de Candida spp. também foi avaliada em diversos estudos, como no de Pfaller e colaboradores, analisando sua atividade in vitro contra diferentes leveduras e fungos filamentosos, provenientes de uma coleção global composta por 2.205 isolados clínicos. Os resultados mostraram que a rezafungina apresentou atividade contra diferentes espécies de Candida, incluindo C. albicansparapsilosis, krusei e tropicalis.7
Análises baseadas em alvos não clínicos de PK/PD e dados de vigilância de suscetibilidade in vitro mostraram que o esquema posológico de dose única semanal da rezafungina conseguiu alcançar, com probabilidades de ≥ 90% e de 100%, valores adequados de AUC/MIC na terceira e sexta semana de terapia, respectivamente, contra isolados de C. albicans e C. glabrata.3
De forma interessante, os resultados desse estudo sugerem que rezafungina pode ser capaz de gerar níveis de exposição associados à eficácia contra alguns isolados dessas duas espécies mesmo na presença de mutações de resistência a equinocandinas e MICs consideravelmente elevados, com probabilidade de 100% de alcançar níveis adequados para isolados de C. albicans com MICs até 0,5mg/L e de 16mg/L para C. glabrata. Os valores de MIC mais elevados para rezafungina entre isolados com a mutação fks, a mais frequentemente associada à resistência a equinocandinas, encontrados até o momento foram de 0,25mg/L para C. albicans e de 2mg/L para C. glabrata.3
Probabilidade percentual contra C. albicans e C. glabrata na semana 4 após a dose com base em alvos Pk/Pd não clínicos
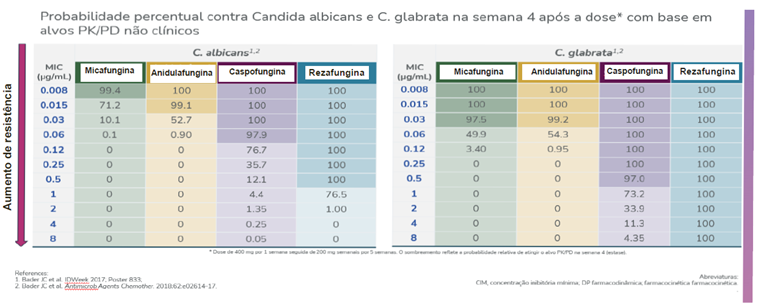
Adaptado de Bader et al., 20183
A emergência de infecções por C. auris é uma causa global de preocupação. Esse patógeno tem especial relevância clínica devido à alta mortalidade associada e ao seu alto potencial de apresentar resistência a antifúngicos.4 Um estudo avaliando espécimes clínicas de C. auris, provenientes de diferentes países e incluindo isolados com MICs elevados para uma ou mais das primeiras equinocandinas, mostrou que rezafungina apresentou atividade contra todas os clados da espécie, o que sugere que a variabilidade genética entre os isolados não comprometeu a atividade desse fármaco.4
Log médio de UFC/g em tecido renal nos dias 1, 4, 7 e 10, após administração intraperitoneal
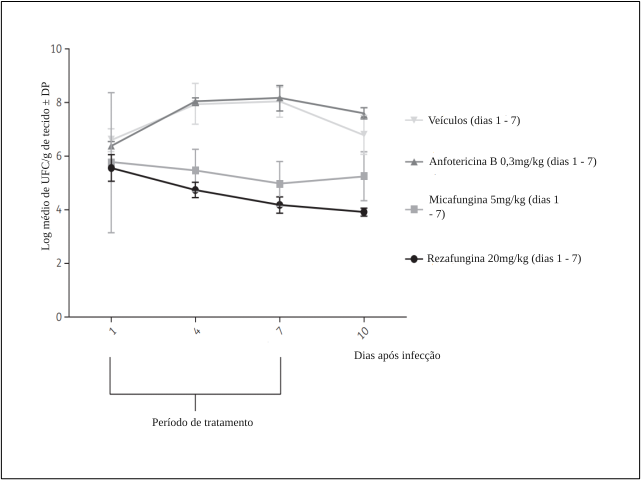
Adaptado de Hager et al, 20188
Penetração e distribuição tecidual
Um estudo em camundongos não imunossuprimidos, conduzido por Zhao et al., avaliou, por meio de espectrometria, a distribuição tecidual e espacial da rezafungina em modelo animal de infecção intra-abdominal por C. albicans em comparação com micafungina. Após administração de uma única dose, ambas as equinocandinas distribuíram-se rapidamente pelos rins e fígado, mas a farmacocinética da exposição foi significativamente diferente. Rezafungina demonstrou extensa penetração tecidual em abscessos hepáticos, com penetração rápida e prolongada no núcleo necrótico.9 Mesmo após 72 horas, os níveis de rezafungina dentro das lesões permaneceram elevados, sendo aproximadamente 6 vezes maior do que os níveis de micafungina alcançados no estado estável. A administração de rezafungina também esteve associada, nesse estudo, a maior redução de carga fúngica e maior proporção de esterilização do tecido hepático em comparação com micafungina.9
Exposição de micafungina vs. rezafungina, após administração de dose única, em lesões hepáticas e tecidos adjacentes
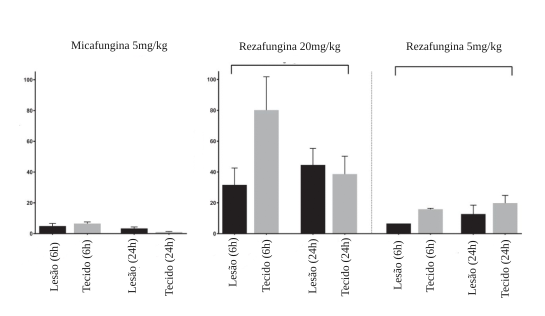
Adaptado de Zhao et al., 20179
Comparação de acumulação de múltiplas doses de micafungina vs. rezafungina
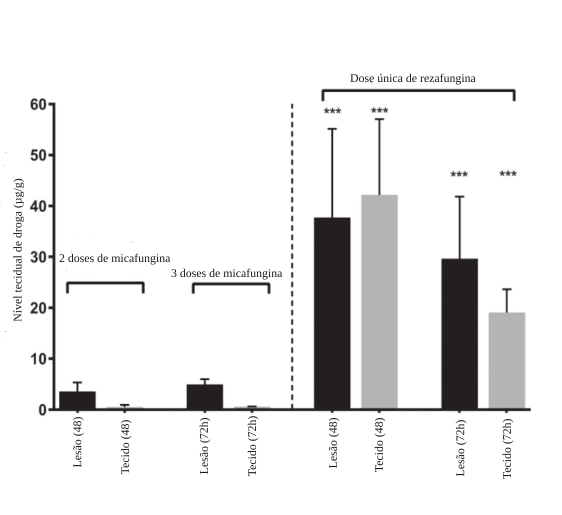
Adaptado de Zhao et al., 20179
Outro estudo de PK/PD, conduzido em ratos, avaliou as razões de concentração tecido/plasma após a administração intravenosa de rezafungina. Os resultados indicaram que, exceto por coração e cérebro, a exposição a essa nova equinocandina foi semelhante em órgãos altamente vascularizados, alcançando razões tecido/plasma de 4 a 5 vezes no fígado, rim, pulmão e baço, demonstrando boa penetração nesses locais.10
Relação de concentração tecido/plasma de rezafungina após administração intravenosa de 5mg/kg em ratos
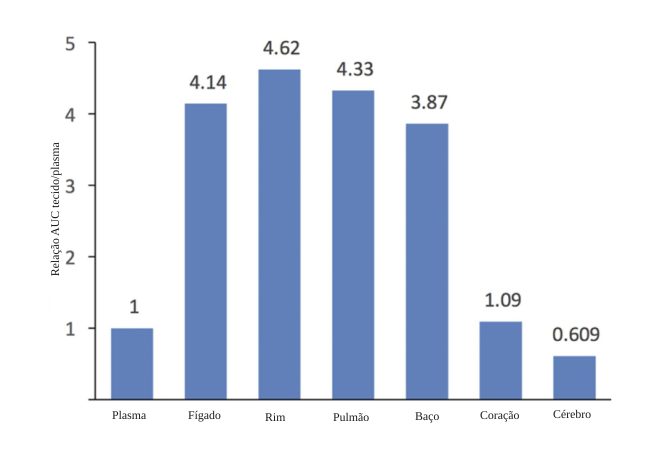
Adaptado de Ong et al., 201710
Mensagem prática
A rezafungina, uma nova geração de equinocandinas, indicada para o tratamento de candidíase invasiva, incluindo candidemia, em adultos, apresenta grande eficácia contra diversas espécies de Candida e seus diferentes perfis de suscetibilidade.5
Suas propriedades diferenciadas conferem maior estabilidade, mesmo em altas temperaturas. Além disso, sua meia-vida prolongada, que somada a dose de ataque, leva à elevada exposição da carga fúngica ao antimicrobiano (AUC/MIC), sua ação in vitro contra diferentes espécies de Candida – incluindo C. auris – e sua boa penetração tecidual em órgãos abdominais em estudo de modelo animal determinam a possibilidade de administração semanal.6,7
Código de aprovação: BR-RZF-2500024
Data de preparo: Janeiro de 2026
Autoria

Isabel Cristina Melo Mendes
Infectologista pelo Hospital Universitário Clementino Fraga Filho (UFRJ) ⦁ Graduação em Medicina na Universidade Federal do Rio de Janeiro
Como você avalia este conteúdo?
Sua opinião ajudará outros médicos a encontrar conteúdos mais relevantes.



